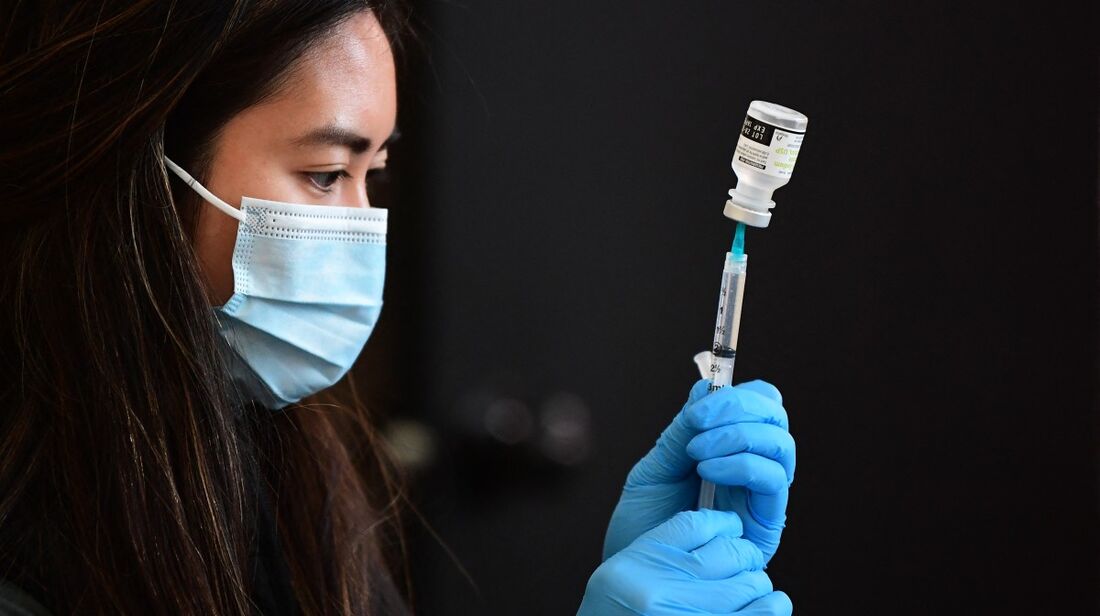
Moderna retira pedido de aprovação de vacina contra gripe e covid-19 nos EUA
A empresa afirmou que vai reapresentar o pedido ainda este ano, sem data específica
A Moderna anunciou nesta quarta-feira (21) que retirou voluntariamente o pedido de aprovação junto à agência reguladora dos Estados Unidos (FDA, na sigla em inglês) para sua vacina combinada contra gripe e covid-19, destinada a adultos com 50 anos ou mais.
A decisão foi tomada "em consulta com a FDA", segundo comunicado oficial da farmacêutica.
Leia também
• Pfizer perde disputa de patente com sul-coreana SK bioscience sobre vacina pneumocócica
• EUA e Europa pausam aplicação da vacina em idosos
• EUA limitará as condições de acesso às vacinas contra a covid-19
O pedido de licenciamento biológico (BLA, na sigla em inglês) para o imunizante mRNA-1083 estava pendente de análise. A Moderna informou que pretende reapresentar o pedido ainda este ano, "após a divulgação de dados de eficácia da vacina contra gripe sazonal mRNA-1010, atualmente em fase 3 de testes clínicos".
Apesar da retirada temporária, a empresa reforçou seu compromisso com o desenvolvimento do imunizante combinado. "A Moderna continua esperando dados interinos do estudo com a mRNA-1010 para este verão do hemisfério norte, que começa em junho", disse.